礦物的螢光並不是「反射」出來的電磁波,而是礦物在吸收我們肉眼看不見的紫外線能量之後,再由礦物「發射」出來的電磁波。這種發光的原理,可以概略地以組成物質的電子軌域和原子間振動的能階來解釋。
組成物質的原子,是以質子和中子所組成的原子核為中心,周圍環繞著電子。電子環繞原子核的軌域有許多不同的型態,電子以不同軌域繞行原子核時所具有不同的能量,而且特定軌域只能夠容納特定數量的電子(圖1)。一般情況下,組成原子的所有電子會從能量最低的軌域開始排列。位在能量最高軌域的電子,容易因會吸收外來的能量,而躍遷到更高能量的軌域。但此時的電子並不穩定,電子傾向躍遷回原來的軌域,並將能量以電磁波的形式釋放出來(圖2)。
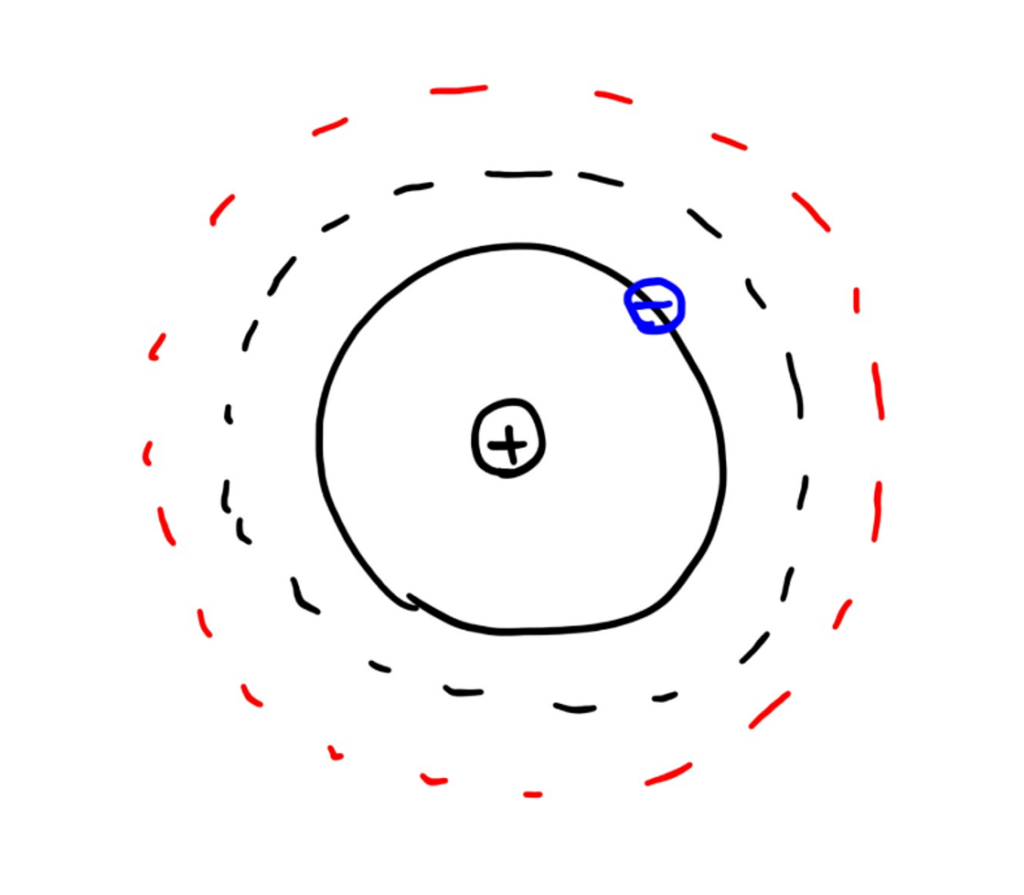
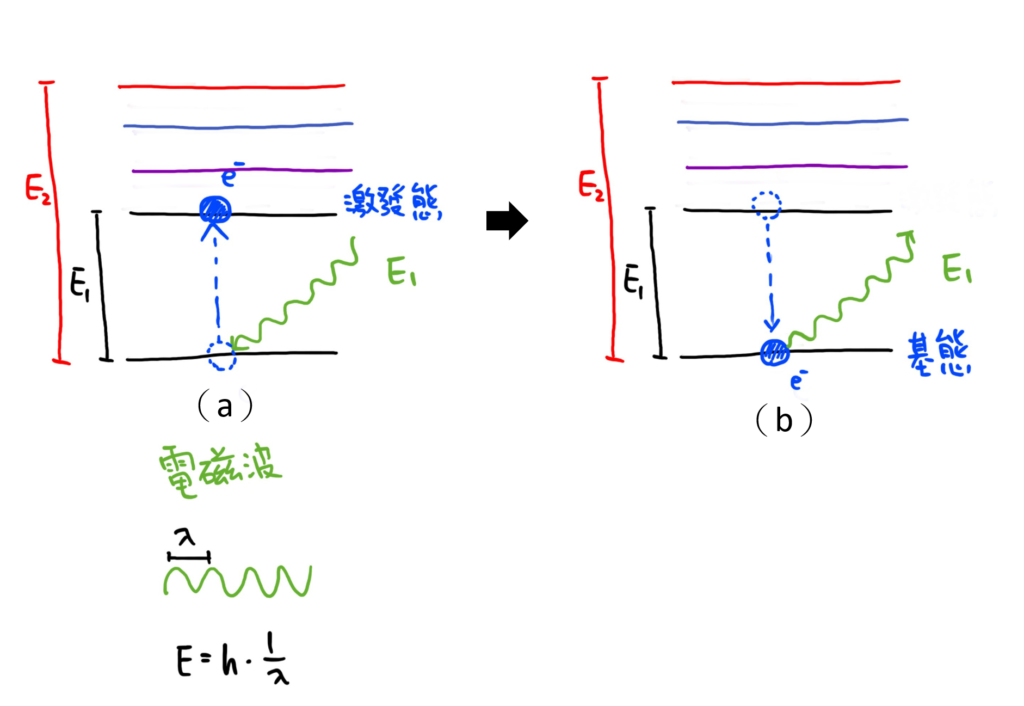
由於電子位在每個不同電子軌域時所具有的能量不同(也不連續),因此我們將這些不同軌域之間的能量差距稱為能階。電子「只能」吸收足以讓它躍遷到其他能階所需要的能量,如果能量太多或太少,都不會電子所吸收。由於電磁波的波長和能量之間,可以透過蒲朗克定律來換算。所以原子會吸收特定波長的能量並造成電子躍遷,而電子躍遷回原本的軌域時,也會發射出同樣波長的電磁波。
如果是許多原子所構成的分子,或是許多分子進一步構成固態物質的晶體結構時,電子軌域的能階就會從單獨的層狀變成帶狀。螢光礦物通常具備一些特殊的原子,我們稱為活化原子(activator)。這些原子在吸收紫外線的能量之後,電子通常會從基態(Ground State)的最低能階(圖3-S0的0)被提升到激發態(Excited State)的其中一個能階(圖3-S1或S2),像圖3中的綠色箭頭。此時電子所獲得的能量,會把能量以振動或轉動的形式釋放,回到激發態的最低能階(圖3-S1的0),像圖3中的黃色波浪箭頭。最後,激發態的電子會從激發態回到基態,並放出螢光,像圖3中的紅色箭頭。
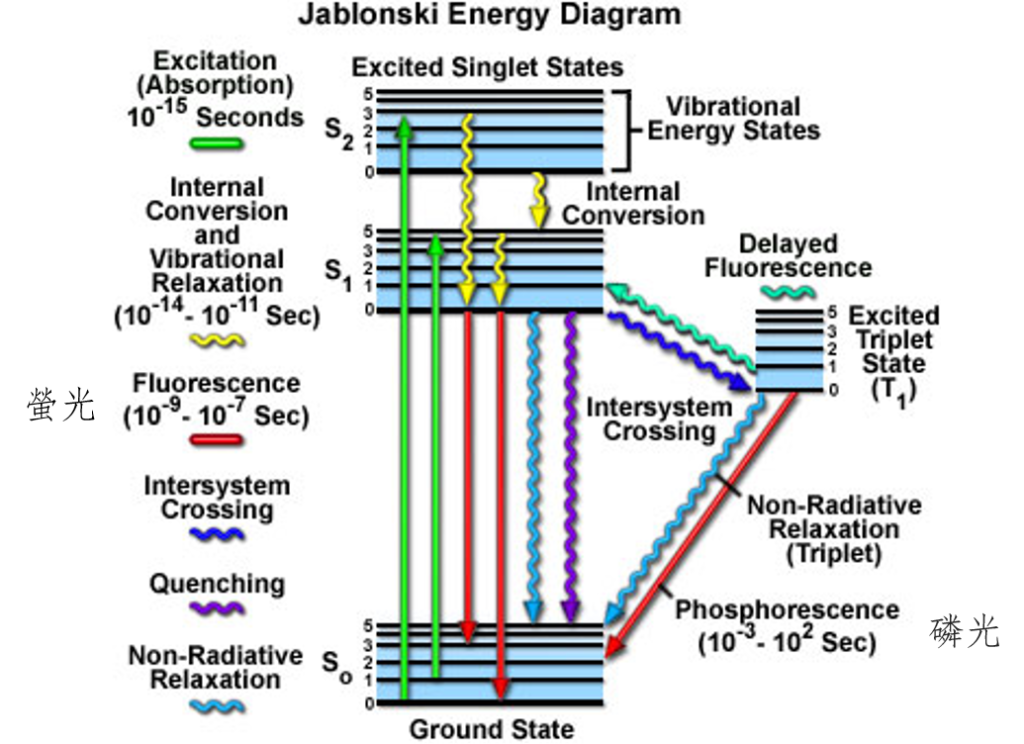
活化原子最大的特徵就是,它能量最低的激發態能階(S1)與基態(S0)能階之間的能量差距很大。當活化原子的能階要從激發態的最低能階回到基態時,能量會以電磁波的形式向外傳遞(圖3),如果電磁波的波長是在可見光的範圍,我們就會看見螢光。
電子的能階躍遷大多發生在非常短暫的時間中(約10-7~10-9秒)。但在少部分的狀況下,電子的能階躍遷會伴隨電子自旋方向的改變,使得電子進入三重激發態的能階(圖3右側的T1),像圖3右側的藍色波浪箭頭。少數狀況下,電子會從三重激發態回到基態,並放出能量。這種能階變化需要比較長的時間(約10-3~102秒)。也就是說,當我們將紫外線的照射關閉之後,還會持續看見發光的現象一陣子,這就是所謂的磷光。
一般來說螢光礦物的發光原理就是這樣,但是部分螢光礦物還是有一些特殊的情況。以下我就介紹一些常見的螢光礦物,以及他們會發出螢光的原理。
→1.前言
→2.甚麼是螢光礦物?
→3.顏色、光線與電磁波
→4.螢光礦物的發光原理
→5.常見的螢光礦物
→6.妨礙螢光生成的「有害」元素
→7.準備紫外線燈具和螢光礦物

3 thoughts on “螢光礦物的發光原理簡介”